章也 1 ,李東陽 1 �,李益民 1 ,羅豐華 1 �,舒暢 2 ,李松 1
(1. 中南大學(xué) 粉末冶金國家重點(diǎn)實(shí)驗(yàn)室��,長沙 410083��;2. 中南大學(xué) 湘雅二醫(yī)院血管外科��,長沙 410011)
摘 要: 作為生物可降解材料����,F(xiàn)e-Mn 合金具備良好的力學(xué)性能和生物相容性,受到廣泛關(guān)注���。本文采用注射成 形制備了Fe-xMn (x=25��,30����,35,質(zhì)量分?jǐn)?shù)�����,下同)合金���,研究了燒結(jié)時(shí)間對 Fe-Mn 合金顯微組織、力學(xué)性能和體外靜態(tài)降解性能的影響�。研究表明:燒結(jié)時(shí)間對 Fe-Mn 合金相組成無明顯影響,而 Mn 含量影響合金的相組成����,F(xiàn)e-35Mn 合金主要由奧氏體組成。所制備注射成形Fe-Mn合金平均晶粒度約為 10~20μm���,表面Mn損失約為5.8%~10.82%���。燒結(jié)時(shí)間為7 h 時(shí),F(xiàn)e-35Mn 合金力學(xué)性能最佳����,拉伸斷裂強(qiáng)度達(dá)到 358 MPa,伸長率為10.83%�,30 天靜態(tài)浸泡降解試驗(yàn)顯示,該合金浸泡一天降解速率為1 mm/y,且隨腐蝕產(chǎn)物堆積而逐漸降低��。
關(guān)鍵詞: 注射成形��;生物可降解合金�����; Fe-Mn 合金�;力學(xué)性能;降解性能
中圖分類號(hào): R318.08 文獻(xiàn)標(biāo)志碼: A
近年來�����,可降解金屬材料在骨科[1]�����、顱面植入[2] 和心血管支架[3]等生物醫(yī)學(xué)領(lǐng)域的應(yīng)用迅速增加�,有望代替?zhèn)鹘y(tǒng)的永久性材料,如:不銹鋼��、鎳鈦合金��、鈷鉻合金�����,解決植入物長存體內(nèi)引發(fā)的各種不良組織反應(yīng)。目前���,鎂基[4]�����、鐵基[5]和鋅基[3, 6]合金是研究較為廣泛的可降解材料。與鎂基和鋅基合金相比����,鐵基合金具備更優(yōu)異的綜合力學(xué)性能,如高的強(qiáng)度�����、良好的延展性和成形性����,一方面能增加植入體的力學(xué)可靠性,另一方面可減少植入金屬用量��,減緩降解產(chǎn)物對人體帶來的負(fù)擔(dān)���。但鐵及其合金降解速率過低��,比如�����,純鐵在 Hank’s 溶液中降解速率僅為 0.008~0.16mm/y����,很長時(shí)間難以體內(nèi)降解。因此��,如何有效提高其降解速率是可降解鐵合金的研究重點(diǎn)[7]���。合金化是解決這一問題的有效途徑之一��,通過添加 Mn����、W�����、S���、Pd等合金元素�����,可在較寬范圍內(nèi)有效調(diào)控降解速率(0.145~25.10 mm/y)[8−9]�����。其中 Mn是比較合適的添加元素���,在人體代謝中,Mn參與氨基酸�����、蛋白質(zhì)和碳水化合物的代謝過程�,在免疫系統(tǒng)的運(yùn)行、能量的調(diào)節(jié)和組織的生長����、凝血過程中扮演著重要角色。研究表明��,就 Fe-Mn 基合金在體液中的降解而言����,Mn的釋放量遠(yuǎn)低于其在血液中的毒性水平�����,逐漸釋放的 Mn 也能被機(jī)體合理代謝[10]�����。與此同時(shí)����,Mn 的電極電位低于Fe����,兩者結(jié)合形成的 Fe-Mn 無限固溶體具有更高的腐蝕電勢[8]。當(dāng)w(Mn)高于29%時(shí)����, Fe-Mn 合金形成單一的奧氏體相,可以提高核磁共振兼容性[11]��。HERMAWAN等[12]率先報(bào)道了Fe-Mn合金作為生物可 降解材料的可行性�����。研究發(fā)現(xiàn),F(xiàn)e-35Mn 合金降解速率提升至0.52 mm/y����,力學(xué)性能與316L不銹鋼相當(dāng),然而其降解速率仍然遠(yuǎn)遜于鎂合金��。
目前報(bào)道的可降解 Fe-Mn合金大多使用粉末冶金[13− 14]���、鑄造[15− 16]���、鍛造[17]等傳統(tǒng)的加工制造工藝獲得,而制備植入體等細(xì)小精密產(chǎn)品時(shí)往往需要配合較多后續(xù)機(jī)加工工序�����,不利于產(chǎn)品工業(yè)化生產(chǎn)�����。金屬注射成形[18− 19]技術(shù)作為新型的精細(xì)零部件制備技術(shù)���,已經(jīng)成功應(yīng)用于較多材料體系的制備,有望成為生物植入體等醫(yī)療產(chǎn)品及器械的制造技術(shù)首選����,但目前尚未有注射成形Fe-Mn可降解合金的相關(guān)研究報(bào)道���。本文利用注射成形技術(shù)制備Fe-xMn (x=25 、30 ���、35)合金�,研究了燒結(jié)時(shí)間對合金成分變化�����、顯微組織�����、力學(xué)性能以及靜態(tài)降解性能的影響����,為后續(xù)注射成形制備可降解 Fe-Mn 生物結(jié)構(gòu)元件提供理論依據(jù)。
1.實(shí)驗(yàn)
實(shí)驗(yàn)所用預(yù)合金Fe-50Mn粉末由湖南恒基粉末有限公司提供�����,通過添加羰基鐵粉可以得到不同 Mn 含量的 Fe-25Mn、Fe-30Mn 和 Fe-35Mn 混合粉末
將上述混合均勻的粉末與多組分粘結(jié)劑(60%石蠟+36.5%高密度聚乙烯+3.5%硬脂酸)在密煉機(jī)中混煉3h���,其中金屬粉末裝載量(體積分?jǐn)?shù)φ��,下同)為 58%���。隨后經(jīng)過造粒、注射得到標(biāo)準(zhǔn)德拉伸樣生坯�,最后通過溶劑脫脂(二氯甲烷、40℃��、8 h)和熱脫脂(氬氣�、600℃、1 h)兩步脫脂法去除粘結(jié)劑�。考慮到 Mn 的熔點(diǎn)為1 244℃�,參照以往的研究[20−21],將燒結(jié)溫度設(shè)置為1200 ℃�,分別燒結(jié)4、7 和 10 h���,爐內(nèi)真空度保持在10−1 Pa。
根據(jù) ASTMB962- 13標(biāo)準(zhǔn)��,采用阿基米德排水法進(jìn)行燒結(jié)坯密度測試,樣品經(jīng)過線切割�,碳化硅砂紙 (180-2000#)逐級打磨,氧化硅熱解懸浮液拋光后測試�����。 錳含量用化學(xué)滴定法測試�����。碳含量和氧含量分別通過CS-600 碳硫分析儀和TCH-600氧碳?xì)浞治鰞x測得����。顯微組織通過掃描電子顯微鏡(SEM, Quanta FEG 250, USA)和電子背散射衍射(EBSD, FEI Helios Nanolab G3 UC, USA)觀察。相組成通過X射線衍射儀(XRD,D8 Advance, Japan)進(jìn)行測定���。室溫力學(xué)拉伸試驗(yàn)在電子萬能材料試驗(yàn)機(jī)(Model 3369, USA)上進(jìn)行�����,拉伸速度2.0 mm/min�,拉伸試樣標(biāo)尺距離為50 mm���,結(jié)果取 三個(gè)平行試樣的平均值����。
體外浸泡實(shí)驗(yàn)參照ASTM-G31-72標(biāo)準(zhǔn) ,在 (37±0.5) ℃恒溫培養(yǎng)箱中進(jìn)行�。將 Fe-35Mn 合金切割成 10 mm×10 mm×5 mm 塊狀樣品,各面經(jīng)過 180~2000#砂紙逐級打磨����,用蒸餾水、無水乙醇逐次清洗烘干��。樣品浸泡在 Hank’s 人工模擬體液中��,樣品表面積與浸泡溶液體積比為 1 cm2:30 mL��。浸泡溶液每兩天更換一次��,靜態(tài)浸泡1�、3、7 �����、15 和 30 天后取出��,用混合溶液(20 g (CN4)2HC6H5O7+100 mL H2O) 在 80 ℃水浴加熱20 min 去除試樣表面沉積的腐蝕產(chǎn)物����,隨后用乙醇超聲清洗烘干,根據(jù)下式計(jì)算腐蝕速率:
CR=8.76×104 W (1)
ATP
式中: W為質(zhì)量損失�,g;A 為腐蝕表面積��,cm2�;
t 為腐蝕時(shí)間,h����;ρ 為樣品密度,g/cm3��。
2 結(jié)果與討論
2.1 雜質(zhì)和密度
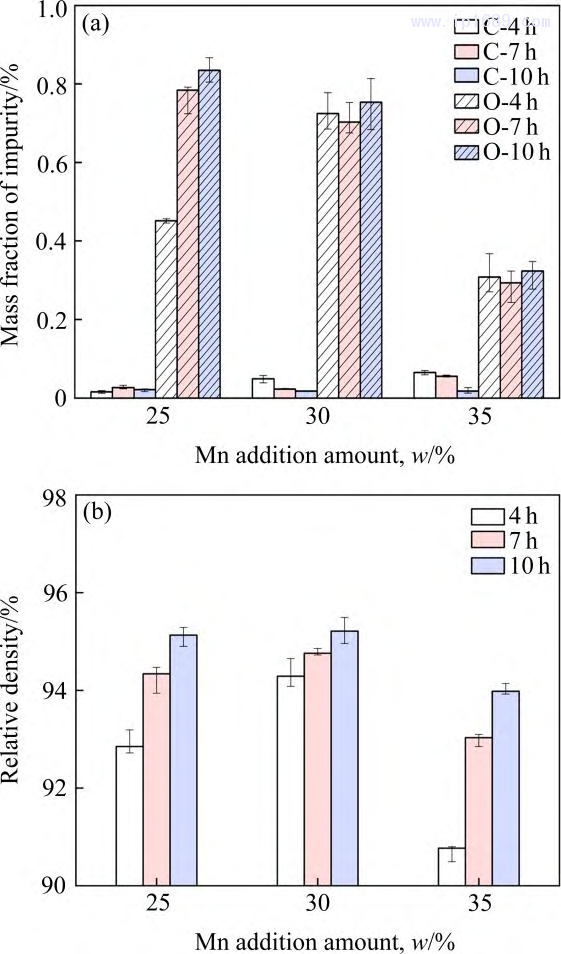
圖1(a)為不同燒結(jié)時(shí)間下Fe-Mn 合金實(shí)際碳含量和氧含量�����。碳含量均低于0.1%��,說明粘結(jié)劑基本脫除����。相同的燒結(jié)時(shí)間下,碳含量隨著Mn含量的增加略有增加��,氧含量則相反。在燒結(jié)過程中����,碳與氧結(jié)合,生成CO 或CO2���,隨著碳含量的增加�����,氧含量逐漸降低�����,因此���,F(xiàn)e-35Mn合金氧含量維持在較低的水平。而過高的氧含量會(huì)損害合金的力學(xué)性能[22]��。圖1(b)為不同燒結(jié)時(shí)間下Fe-Mn 合金的致密度����。合金的密度隨著燒結(jié)保溫時(shí)間的延長逐漸增加,隨著Mn 含量的增加先增加后下降��,其中Fe-30Mn 合金的密度最大,這可能與Mn原子的擴(kuò)散速率變化有關(guān)�。研究表明[23−24] Mn的擴(kuò)散系數(shù)隨著Mn含量的增加先增大后減小,較大的擴(kuò)散系數(shù)可提高合金燒結(jié)活性����,加速晶粒長大����,因此合金的氣孔和晶界逐漸減少,樣品的總體積收縮����,密度增加。
圖 1 不同燒結(jié)時(shí)間 Fe-Mn 合金雜質(zhì)含量(a)和致密度(b)
2.2 Mn 的損失
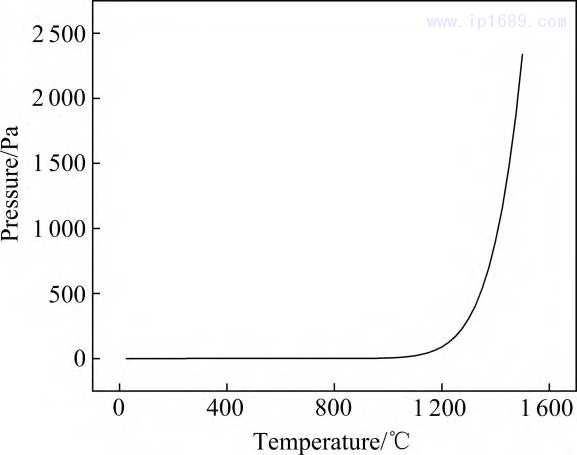
錳在真空環(huán)境下容易揮發(fā)和氧化����,很大程度上影響了高質(zhì)量鐵錳合金的制備和利用[25]。溫度和壓力會(huì)影響Mn的揮發(fā)程度�,Mn 的平衡蒸汽壓隨溫度的變化曲線如圖 2 所示??梢钥闯觯?100 ℃以下蒸汽壓極低且變化不大���,降低燒結(jié)溫度可以減少揮發(fā)�����,但過低的溫 度不利于燒結(jié)致密化��。 1200℃時(shí)Mn的平衡蒸汽壓為1.55 Pa��,高于1200℃后蒸汽壓急劇上升�,因此,本研究以 1200℃作為燒結(jié)溫度��。燒結(jié)過程中真空度為10−1Pa��,爐內(nèi)壓力小于Mn 的平衡蒸汽壓���,顯然不可避免存在 Mn 的揮發(fā)[26]�����。
圖 2 Mn 的平衡蒸汽壓隨溫度變化曲線
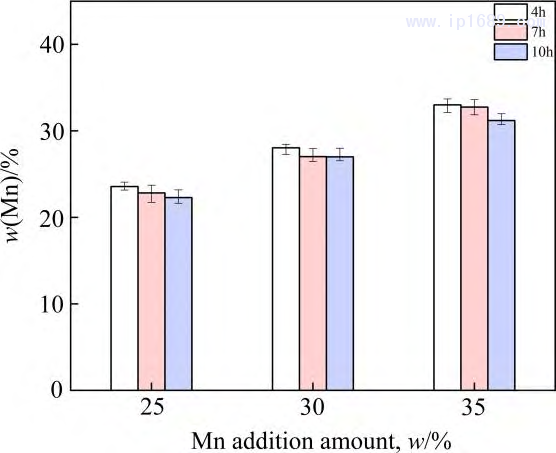
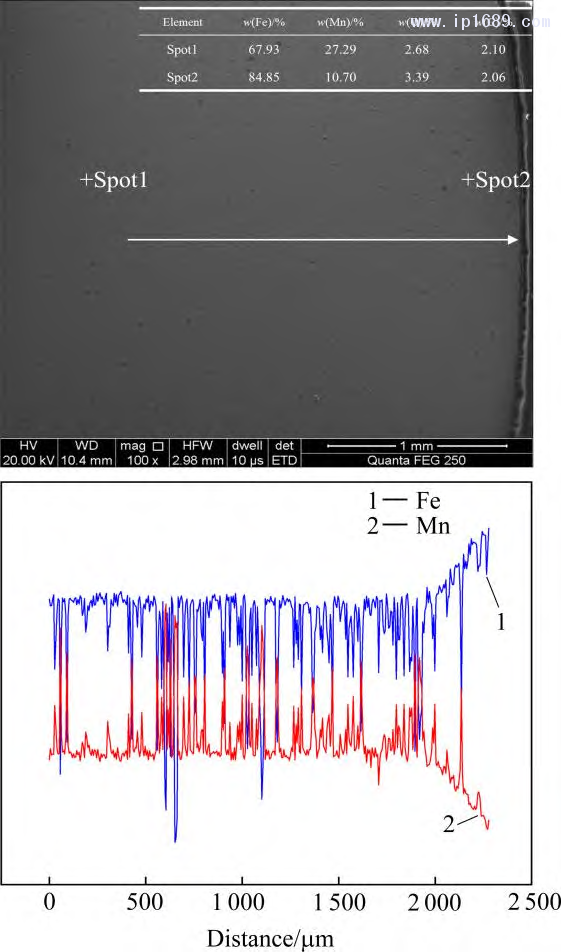
保溫時(shí)間越長�����,Mn 的揮發(fā)越嚴(yán)重����,而Fe的揮發(fā)相對于Mn的揮發(fā)可以忽略不計(jì)[27]���。圖3為不同燒結(jié)時(shí)間下Fe-Mn 合金中Mn含量。隨著燒結(jié)時(shí)間的延長���,Mn的損失逐漸增加�����,燒結(jié)4 、7和10h 后相比于名義成分Mn 的平均收得率分別為94.2%�、92.14%和 89.18%。圖4為燒結(jié)7 h Fe-30Mn合金的SEM 圖像和線掃描圖���。 Mn的平均質(zhì)量分?jǐn)?shù)在25%~28%之間��,進(jìn)一步證實(shí)Mn的揮發(fā)��,靠近試樣表面 300~400μm 的區(qū)域內(nèi)��,Mn 的含量急劇下降����。過多Mn 的揮發(fā)會(huì)改變合金實(shí)際成分與相組成��,也對真空燒結(jié)設(shè)備帶來污染。因此���,必須從兩方面來控制Mn的揮發(fā)��。一方面���,需要合理設(shè)計(jì)燒結(jié)溫度,調(diào)控爐內(nèi)壓力���,保證爐內(nèi)壓力大于燒結(jié)溫度下Mn 的平衡蒸汽壓�����,從而抑制 Mn 的揮發(fā)��。另一方面�����,可以根據(jù)燒結(jié)保溫時(shí)間與Mn的收得率之間的關(guān)系��,保證合金Mn含量與燒結(jié)保溫時(shí)間的平衡���。
圖3 燒結(jié)時(shí)間和Mn添加量對Fe-Mn合金中Mn的影響
圖4 燒結(jié) 7 h Fe-30Mn 合金 SEM 圖像和線掃描分析
2.3 XRD 與 SEM 分析
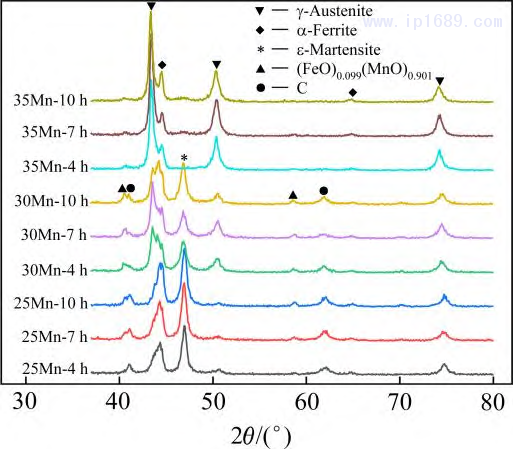
圖5為不同燒結(jié)時(shí)間下Fe-Mn合金的XRD圖譜��?�?梢钥闯?�,燒結(jié)時(shí)間對 Fe-Mn 合金的相組成無明顯影響�����,而 Mn含量會(huì)影響合金相組成和衍射峰的位置��。Fe-25Mn 和 Fe-30Mn 合金主要由奧氏體�、鐵素體和馬氏體相組成���,但隨著Mn含量的增加,奧氏體含量相對增加�����, 鐵素體和馬氏體含量減少��。其中�����,F(xiàn)e-35Mn 合金主要由奧氏體組成,少量-Fe 相的存在可能與局部成分不均勻有關(guān)[20]�����。此外��,隨著Mn含量的增加����,應(yīng)奧氏體的衍射峰向左偏移,這是由于Mn在鐵基體 中的固溶量增加��,奧氏體晶格常數(shù)增大所致���。由于Fe和Mn都易氧化����,因此在圖中均存在對應(yīng)氧化物的衍射峰�����,并且隨著Mn含量的增加�,氧含量逐漸降低�����,氧化物衍射峰逐漸減弱�。
圖 5 不同燒結(jié)時(shí)間 Fe-Mn 合金的 XRD 圖譜
圖6為燒結(jié)7 h Fe-Mn 合金的SEM 圖像和能譜分析數(shù)據(jù)�。通過EDS能譜分析可以看出,相比于名義成分����,基體的錳含量有一定的損失?���;w中彌散分布著一定量的雜質(zhì)相,F(xiàn)e-25Mn 和 Fe-30Mn 合金的雜質(zhì)相大多為錳的氧化物���,而Fe-35Mn 合金的雜質(zhì)相主要以鐵的氧化物為主���,并且隨著Mn 含量的增加���,氧化物逐漸減少���,這與XRD結(jié)果相一致。
2.4 晶粒尺寸分析
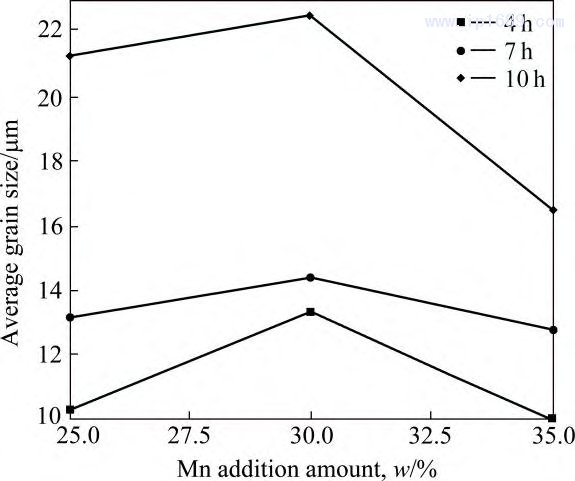
圖7為不同燒結(jié)時(shí)間下Fe-Mn合金的晶粒分布圖,可以明顯看到���,所有合金的晶粒尺寸較為均勻����,且隨著燒結(jié)保溫時(shí)間的延長而逐漸增大��。圖8為不同 燒結(jié)時(shí)間下Fe-Mn合金的平均晶粒尺寸�,合金晶粒尺寸隨 Mn 含量的增加先增加后下降,F(xiàn)e-30Mn 合金的晶粒尺寸最大����,這與Mn的擴(kuò)散系數(shù)變化規(guī)律一致。
Mn 含量相同的情況下�����, 隨著燒結(jié)保溫時(shí)間的延長���, 晶粒逐漸長大���。
圖 7 不同燒結(jié)時(shí)間 Fe-Mn 合金的晶粒分布圖
圖 8 不同燒結(jié)時(shí)間 Fe-Mn 合金平均晶粒尺寸
2.5 室溫拉伸力學(xué)性能
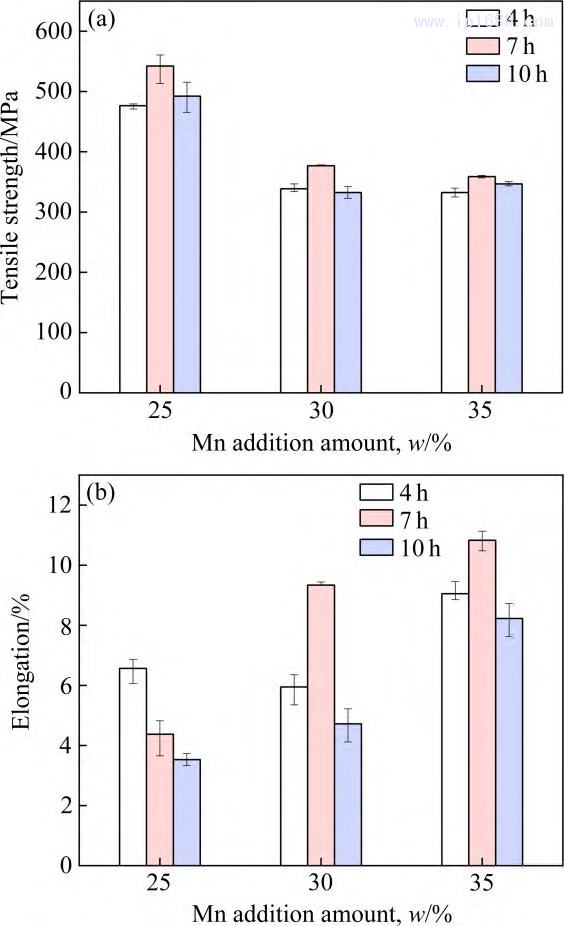
圖9為不同燒結(jié)時(shí)間Fe-M下合金的室溫拉伸力學(xué)性能。其中抗拉強(qiáng)度如圖 9(a)所示�,三種 Fe-Mn 合金均在燒結(jié)7h后獲得最高抗拉強(qiáng)度�。如前所述����,F(xiàn)e-25Mn、Fe-30Mn�、Fe-35Mn 隨著燒結(jié)時(shí)間由4h延長至10h,致密度分別由92.85%�����、94.29%��、90.77%提升至95.13%�、95.21%、93.98%�,孔隙的減少雖有利于抗拉強(qiáng)度的提高。但平均晶粒度的大幅提高(圖8) �,導(dǎo)致細(xì)晶強(qiáng)化機(jī)制減弱,從而使合金的抗拉強(qiáng)度降低��。
相同的燒結(jié)時(shí)間��,隨著Mn含量的增加�,合金的抗拉強(qiáng)度逐漸下降��。
研究發(fā)現(xiàn)Fe-Mn 合金中Mn含量的提高會(huì)降低彈 性模量, 提高塑性[28]����。如圖9(b)所示, 合金伸長率整體上隨Mn含量增加而逐漸增加����。對三種 Fe-Mn 合金而言,當(dāng)燒結(jié)時(shí)間為7 h 時(shí)���,F(xiàn)e-30Mn 和Fe-35Mn合金不僅擁有最高的抗拉強(qiáng)度�����,其伸長率也最高�,而對于Fe-25Mn 合金��,燒結(jié)7 h的伸長率相較與4 h要差���,可能與其雜質(zhì)氧含量的成倍增長有關(guān)��,過高的氧含量 會(huì)導(dǎo)致合金的脆性增加[29]�����。
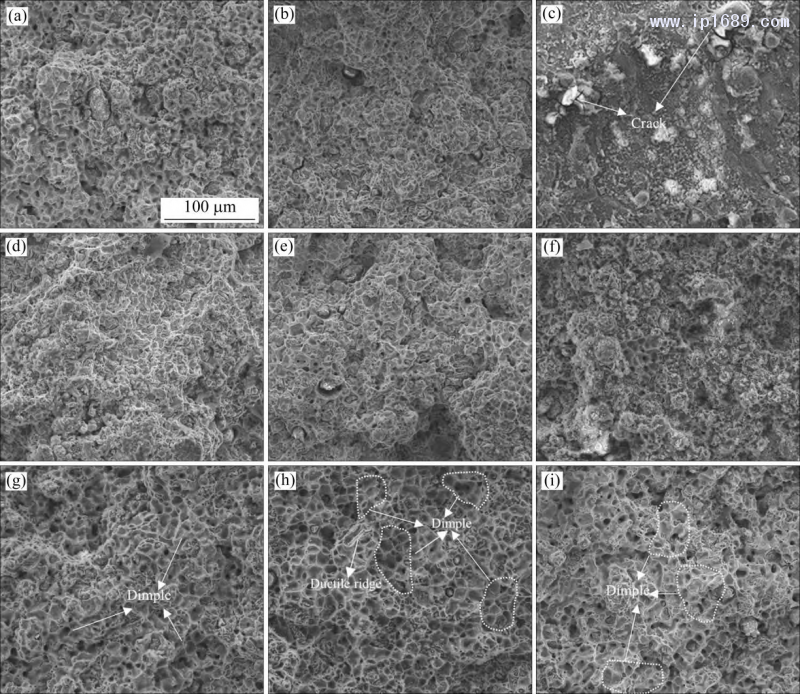
圖 10 為不同燒結(jié)時(shí)間 Fe-Mn 合金室溫拉伸斷口形貌圖���。相同的燒結(jié)時(shí)間�,隨Mn含量的增加�����,合金 的韌窩數(shù)量增多��,韌性更好���。Fe-35Mn合金斷口均表現(xiàn)出大而多的韌窩(圖 10(g)~(i))����。Mn 含量相同時(shí)�����,隨著燒結(jié)時(shí)間的延長���,三種 Fe-Mn 合金的塑性先升高后降低����,其中���,F(xiàn)e-25Mn 合金燒結(jié)10h斷口表現(xiàn)為韌−脆過渡斷裂特征�����,可以清楚地看到準(zhǔn)解離斷裂形貌����,并且伴隨著裂紋的產(chǎn)生(圖10(c))���。燒結(jié)7 h的 Fe-35Mn合金顯示出大量的塑性脊和較大的韌窩(圖10(h))�����,塑性相對最好�,與圖9(b)一致�。
本研究通過注射成形制備的Fe-Mn合金在抗拉強(qiáng)度方面滿足了臨床上對可降解血管支架材料的要求,抗拉強(qiáng)度大于300 MPa����,但伸長率低于15%,與同成分通過熔煉法制備的Fe-Mn 降解合金存在差距[30]�,主要原因在于不能完全消除的孔隙和較高的碳氧雜質(zhì)��。金屬注射成形可降解 Fe-Mn 合金的開發(fā)���,有利于實(shí)現(xiàn)復(fù)雜微細(xì)零部件、植入體的精確快速制備���,但是需要對成分設(shè)計(jì)��、原材料制備�����、雜質(zhì)控制等方面進(jìn)一步開展研究����,提高產(chǎn)品綜合力學(xué)性能����。
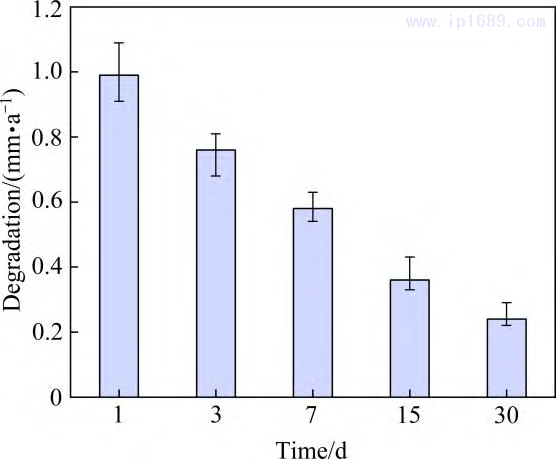
金進(jìn)行靜態(tài)浸泡降解性能研究。圖11 為燒結(jié)7hFe-35Mn 合金的降解速率隨浸泡時(shí)間的變化����。可以看出,隨著浸泡時(shí)間的延長���,合金的降解速率逐漸下降�,與其它靜態(tài)浸泡測試實(shí)驗(yàn)現(xiàn)象相似���,歸因于表層腐蝕 產(chǎn)物的堆積[14, 31]。圖12為降解15天合金表面微觀組織形貌圖��,點(diǎn)掃描分析顯示表面覆蓋物以氧化物和磷酸鹽為主���。鐵的降解速率為0.008~0.036 mm/y�,其降解速率與永久支架無異[7]�。本研究中Fe-35Mn 合金浸泡一天時(shí)降解速率可以達(dá)到1 mm/y,高于純鐵和大部分鐵基合金����。本研究制備的Fe-Mn進(jìn)一步拉近了鐵合金與鎂合金的降解周期,有望在12~24月實(shí)現(xiàn)完全降解��。
圖 10 不同燒結(jié)時(shí)間 Fe-Mn 合金室溫拉伸斷口形貌
圖11 Fe-35Mn-7h合金的降解速率隨浸泡時(shí)間變化 圖 12 Fe-35Mn-7h 合金浸泡 15天表面組織形貌圖
除成份外�����,降解速率受晶粒尺寸、雜質(zhì)含量���、孔隙率以及降解環(huán)境影響較大�。研究表明[32]晶粒越細(xì)小均勻���,相對晶界密度越高�, 晶粒內(nèi)部與晶界之間所形成的微電偶腐蝕能增加降解速率�。雜質(zhì)含量偏高,帶來的雜質(zhì)相也有類似的效應(yīng)[33]�。孔隙率也是影響合金降解速率的重要因素��,額外的孔隙會(huì)增加合金在腐蝕環(huán)境中的暴露面積����,提高降解速率[31]。研究報(bào)道[14] 的多孔可降解合金�����,降解速率達(dá)2~8 mm/y�。當(dāng)前鐵基生物可降解合金所面臨的最大難題是降解速率過慢,不能在治療周期內(nèi)及時(shí)代謝移除����,因此如何在保證合金力學(xué)可靠性的同時(shí)提高其降解速率�,使其在體內(nèi)完全降解的速度與組織修復(fù)的速度相匹配仍然需要進(jìn)一步研究�。
3 結(jié)論
本文設(shè)計(jì)制備了注射成形 Fe-xMn (x=25、30���、35) 合金��,研究了燒結(jié)時(shí)間對 Fe-Mn 合金中 Mn 的揮發(fā)損失以及顯微組織�����、力學(xué)性能、體外靜態(tài)降解性能的影響�,主要結(jié)論如下:
1) 燒結(jié)時(shí)間對Fe-Mn合金的相組成無明顯影響,而Mn含量會(huì)影響合金的相組成�,其中 Fe-35Mn合金主要由奧氏體組成;燒結(jié)過程中存在碳與氧的反應(yīng)和Mn的揮發(fā)����,F(xiàn)e-35Mn合金氧含量維持在較低水平,Mn的揮發(fā)在試樣表面300~400μm區(qū)域內(nèi)尤為明顯���;Fe-Mn合金的致密度為90.8%~95.1%�����,平均晶粒度約為 10~20μm��,兩者隨著燒結(jié)保溫時(shí)間延長而增加����。
2) Fe-Mn合金抗拉強(qiáng)度隨著燒結(jié)保溫時(shí)間的延長 先增加后降低,伸長率隨Mn含量增加而逐漸增加�����,燒結(jié)時(shí)間為7h的Fe-35Mn 合金抗拉強(qiáng)度達(dá)358 MPa��,伸長率達(dá) 10.83%��。
3) 燒結(jié)7hFe-35Mn 合金降解速率達(dá)到1 mm/y��,高于大多數(shù)其它方法制備的同類合金���;隨著浸泡時(shí)間的延長���,表層腐蝕產(chǎn)物的堆積會(huì)使合金的降解速率逐漸下降。
參考文獻(xiàn)
[1] LI Zijian, GU Xunan, LOU Siquan, et al. The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J]. Biomaterials, 2008, 29(10): 1329−1344.
[2] SARAHE, HENDERSONA, KONSTANTIONSVB, et al. Magnesium alloys as a biomaterial for degradable craniofacial screws[J]. Acta Biomaterialia, 2014, 10(5): 2323−2332.
[3] YANG Hongtao, WANG Cong, LIU Chaoqiang, et al. Evolutionof the degradation mechanism of pure zinc stent in the one-year study of rabbit abdominal aorta model[J]. Biomaterials, 2017,145: 92−105.
[4] SCHRANZ D, ZARTNER P, MICHEL-BEHNKE I, et al. Bioabsorbable metal stents for percutaneous treatment of critical recoarctation of the aorta in a newborn[J]. Catheterization and Cardiovascular Interventions, 2010, 67(5): 671−673.
[5] 徐文利, 吳競堯, 譚麗麗, 等. 可降解鐵基心血管支架材料的研究進(jìn)展[J]. 材料導(dǎo)報(bào), 2012, 26(1): 75−78.
[6]GONG Haibo, WANG Kun, STRICH R, et al. In vitro biodegradation behavior, mechanical properties, and cytotoxicity of biodegradable Zn-Mg alloy[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(8):1632−1640.
[7] PEUSTER M, WOHLSEIN P, EHLERDING M, et al. A novel approach to temporary stenting: degradable cardiovascular stents produced from corrodible metal-results 6- 18 months after implantation into New Zealand white rabbits[J]. Heart, 2001,86(5): 563−569.
[8] SCHINHAMMER M, HANZI A C, LOFFERR J F, et al. Design strategy for biodegradable Fe-based alloys for medical applications [J]. Acta Biomaterialia, 2010, 6(5): 1705−1713.
[9] LIU B, ZHENG Y F. Effects of alloying elements (Mn, Co, Al, W, Sn, B, C and S) on biodegradability and in vitro biocompatibility of pure iron [J]. Acta Biomaterialia, 2011, 7(3):1407−1420.
[10] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852−1860.
[11]RABINKIN A. On magnetic contributions to γ→ε phase transformations in Fe-Mn alloys[J]. Calphad-Computer Coupling of Phase Diagrams & Thermochemistry, 1979, 3(2): 77−84.
[12] HERMAWAN H, ALAMDARI H, MANTOVANI D, et al. Iron-manganese: New class of metallic degradable biomaterials prepared by powder metallurgy[J]. Powder metallurgy, 2008, 51(1): 38−45.
[13] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852− 1860.
[14] ZHANG Qian, CAO Peng. Degradable porous Fe-35wt.% Mn produced via powder sintering from NH4HCO3 porogen[J]. Materials Chemistry Physics, 2015, 163: 394−401.
[15] DRYNDA A, HASSEL T, BACH F W, et al. In vitro and in vivo corrosion properties of new iron-manganese alloys designed forcrdiovascular applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(3): 649−660.
[16] LIU B, ZHENG Y F, RUAN Liquan. In vitro investigation of Fe30Mn6Si shape memory alloy as potential biodegradable metallic material[J]. Materials Letters, 2011, 65(3): 540−543.
[17]CAPEK J, KUbaseK J, DALIBOR V, et al. Microstructural, mechanical, corrosion and cytotoxicity characterization of the hot forged FeMn30(wt.%) alloy[J]. Materials Science & Engineering C, 2016, 58: 900−908.
[18] 舒暢, 蔡文武, 何昊, 等. 粉末冶金注射成型技術(shù)制備的新型血管內(nèi)支架的動(dòng)物應(yīng)用研究[J ].中國普通外科雜, 2017, 26(2): 205−212.
[19] MARIOT P, LEEFLANG M A, SCHAEFFER L, et al. An investigation on the properties of injection-molded pure iron potentially for biodegradable stent application[J]. Powder Technology, 2016, 294: 226−235.
[20] HERMAWAN H, DUBE D, MANTOVANI D. Development of degradable Fe-35Mn alloy for biomedical application[J].Advanced Materials Research, 2007, 15/17: 107−112.
[21] HERMAWAN H, DUBE D, MANTOVANI D. Degradable metallic biomaterials: design and development of Fe-Mn alloys for stents[J]. Journal of Biomedical Materials Research Part A,2009, 93(1): 1−11.
[22] 曲選輝, 陳曉瑋, 章林, 等. 一種低氧含量的母合金法制備MIM418 合金的方法: 中國, 201611100809.7[p]. 2018−03−13.
[23] 李夢珊, 范景蓮, 劉濤, 等. Mn 含量對 Cu-Mn 合金結(jié)構(gòu)與性能的影響[J]. 粉末冶金材料科學(xué)與工程, 2016, 21(4): 541−545.
[24] THIBON I, GUILLOU A, GLORIANT T. Interdiffusion in the FCC phase of Cu-Mn binary alloys[J]. Journal of Phase Equilibria & Diffusion, 2012, 33(4): 303−309.
[25]孔令種, 鄧志銀, 朱苗勇. 中高錳鋼在真空精煉過程中的氣化行為[J]. 特殊鋼, 2018, 39(4): 17−19.
[26] 侯少良. 真空感應(yīng)熔煉中錳的揮發(fā)與控制[J]. 上海金屬, 1992,14(2): 60−61.
[27] 王信才. 功能材料 Fe-Mn 合金試制工藝研究[J]. 特鋼技術(shù),2010, 16(1): 21−23.
[28] 李冬冬, 錢立和, 劉帥, 等. Mn 含量對 Fe-Mn-C 孿生誘發(fā)塑性鋼 拉伸變形行為 的 影 響[J]. 金屬學(xué)報(bào) , 2018, 54(12):1777−1784.
[29] KURAMOTO S, FURUTA T, HWANG J H, et al. Plastic deformation in a multifunctional Ti-Nb-Ta-Zr-O alloy[J]. metallurgical & Materials Transactions A, 2006, 37(3): 657−662.
[30] BOWEN P K, SHEARIER E R, ZHAO S, et al. Biodegradable metals for cardiovascular stents: From clinical concerns to recent Zn‐alloys[J]. Advanced Healthcare Materials, 2016, 5(10):1121−1140.
[31] 李涵, 王燁欣, 崔振山, 等. 噴射成形制備 Fe-35Mn合金的體外降解行為及生物相容性[J]. 腐蝕科學(xué)與防護(hù)技術(shù), 2018,30(3): 244−250.
[32] 陳連喜. 含鍶生物醫(yī)用鎂合金的性能及其應(yīng)力腐蝕行為研究[D]. 廣州: 暨南大學(xué), 2017: 1−129.
[33] 高家誠, 伍沙, 喬麗英, 等. 鎂及鎂合金在仿生體液中的腐蝕降解行為[J]. 中國組織工程研究與臨床康復(fù), 2007, 18(2): 3584−3586.